How properties of water support life – L’acqua e la vita: come le sue proprietà sostengono la vita, questo è il cuore della questione. Sembra banale, vero? Eppure, le straordinarie caratteristiche dell’acqua, da semplice H₂O, sono fondamentali per l’esistenza di ogni forma di vita sul nostro pianeta. Preparati a scoprire come questa molecola apparentemente semplice sia in realtà un’architetto della vita stessa, influenzando tutto, dalla nostra temperatura corporea alla complessità delle nostre cellule.
Esploreremo le proprietà uniche dell’acqua, come la sua capacità di sciogliere numerose sostanze (proprietà solvente), la coesione e adesione che permettono il trasporto di liquidi nelle piante, il suo elevato calore specifico che stabilizza le temperature, e la sua insolita densità che protegge la vita acquatica. Vedremo come queste proprietà interagiscono in modo sinergico per creare le condizioni perfette per la vita, così come la conosciamo.
Proprietà del Solvente Universale: How Properties Of Water Support Life
L’acqua è spesso definita il “solvente universale” grazie alla sua straordinaria capacità di sciogliere una vasta gamma di sostanze. Questa proprietà fondamentale è alla base di molti processi biologici cruciali per la vita. La sua efficacia come solvente deriva principalmente dalla sua struttura molecolare e dalle interazioni che essa instaura con altre molecole.
Polarità dell’Acqua e Solubilità
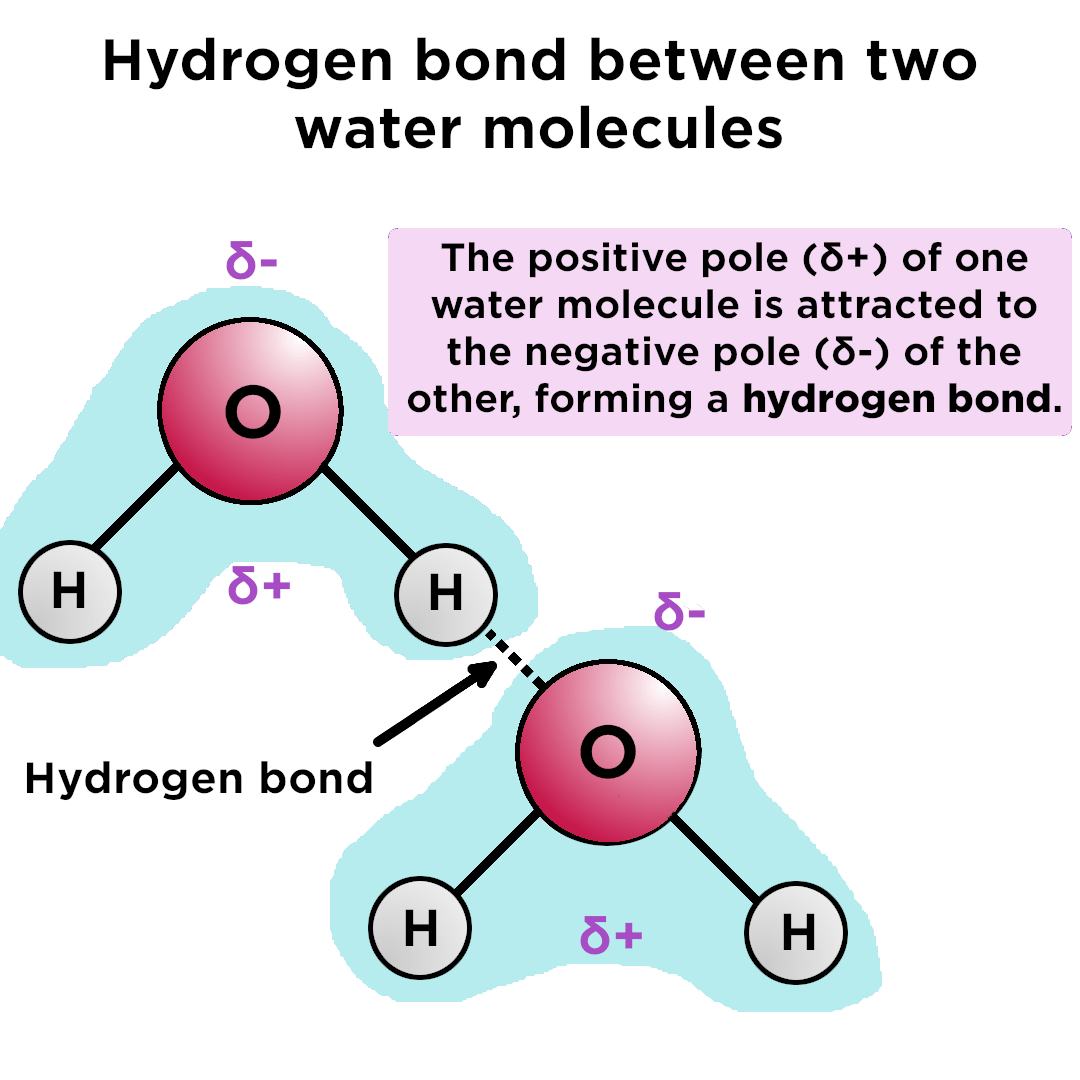
La molecola d’acqua (H₂O) è una molecola polare. Questo significa che la carica elettrica non è distribuita uniformemente: l’ossigeno è più elettronegativo dell’idrogeno, attirando a sé gli elettroni di legame e creando una parziale carica negativa (δ-) sull’ossigeno e parziali cariche positive (δ+) sugli atomi di idrogeno. Questa distribuzione asimmetrica della carica crea un dipolo elettrico. La polarità dell’acqua le permette di interagire fortemente con altre molecole polari, formando legami a idrogeno e permettendo la dissoluzione di composti ionici e polari. Molecole apolari, invece, tendono ad essere insolubili in acqua perché non possono formare legami forti con le molecole d’acqua. Un esempio pratico è lo zucchero (polare) che si scioglie facilmente in acqua, mentre l’olio (apolare) non lo fa.
Tipi di Legami Chimici nell’Interazione Acqua-Molecole Biologiche
L’acqua interagisce con le biomolecole attraverso diversi tipi di legami chimici, fondamentali per la struttura e la funzione di queste ultime.
| Tipo di Legame | Molecole Coinvolte | Forza del Legame | Ruolo Biologico |
|---|---|---|---|
| Legame a Idrogeno | Acqua-Acqua, Acqua-Proteine, Acqua-Zuccheri | Debole | Stabilizza la struttura secondaria e terziaria delle proteine, influenza la struttura del DNA e dell’RNA, contribuisce alla coesione dell’acqua. |
| Legame Ionico | Acqua-Sali minerali (es. NaCl) | Relativamente forte | Permette la dissoluzione di sali minerali essenziali per il metabolismo cellulare, contribuisce alla regolazione del pH. |
| Interazioni dipolo-dipolo | Acqua-Molecole polari (es. glucosio) | Debole | Contribuisce alla solubilità di molecole polari, influenza le proprietà di trasporto delle membrane cellulari. |
| Interazioni dipolo-dipolo indotto | Acqua-Molecole apolari (es. lipidi) | Molto debole | Contribuisce alla parziale solubilità di alcune molecole apolari, influenza la formazione di micelle. |
Confronto con Altri Solventi
Mentre l’acqua è un solvente eccezionale, altre sostanze possiedono proprietà solventi diverse. Ad esempio, l’etanolo è un buon solvente sia per sostanze polari che per alcune apolari, grazie alla sua natura anfipatica (possiede sia una parte polare che una apolare). Solventi organici come l’esano o il benzene sono invece ottimi solventi per sostanze apolari, ma non per quelle polari. La capacità solvente dell’acqua è superiore a quella di molti altri solventi grazie alla combinazione della sua polarità, alla capacità di formare legami a idrogeno e alla sua alta costante dielettrica, che riduce la forza di attrazione tra ioni di carica opposta.
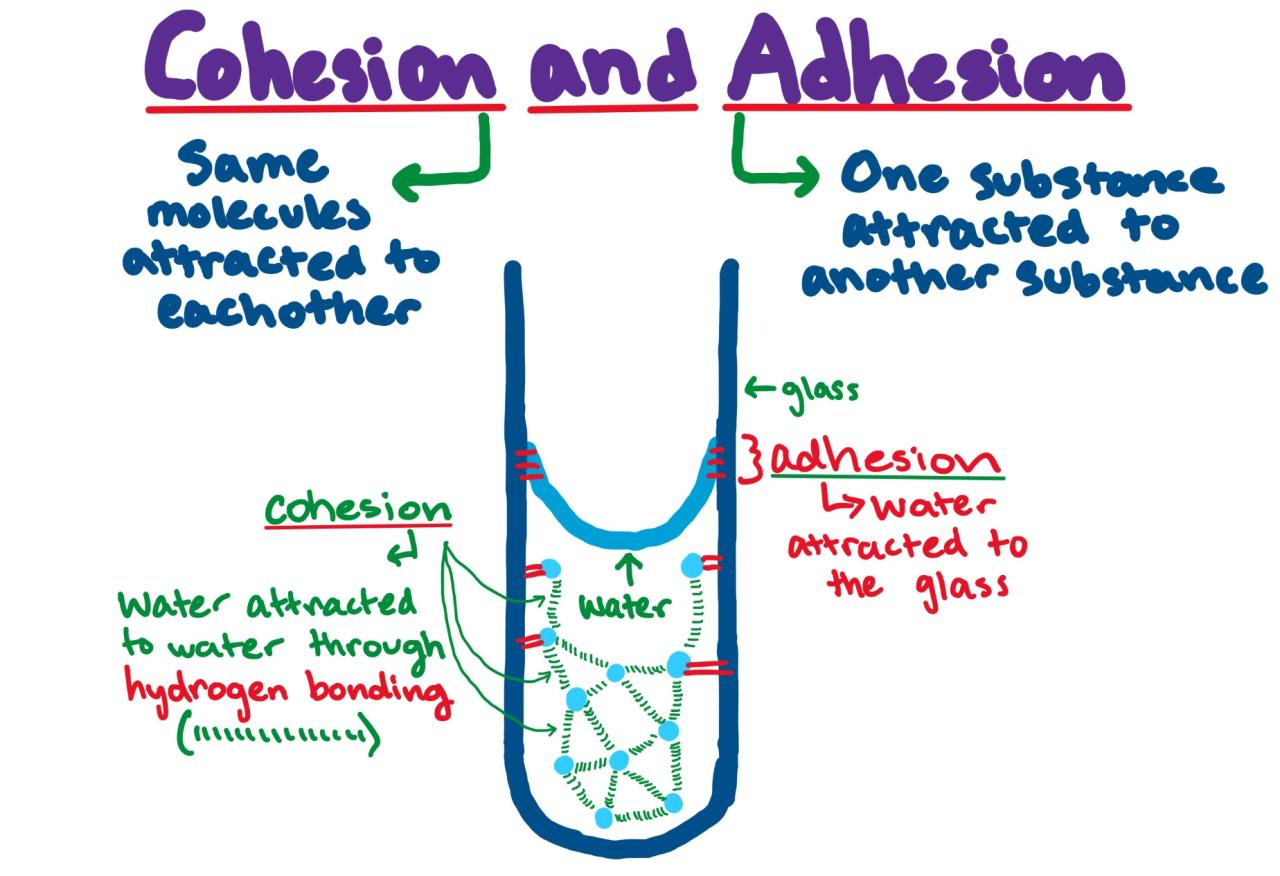
Coesione e Adesione
Source: cloudfront.net
L’acqua, oltre ad essere un solvente universale, possiede altre proprietà fondamentali per la vita, tra cui la coesione e l’adesione. Queste due forze, apparentemente semplici, sono alla base di molti processi biologici cruciali, garantendo la sopravvivenza di innumerevoli organismi. Capire come queste proprietà agiscono ci aiuta a comprendere meglio il funzionamento del mondo vivente.
La coesione è la forza di attrazione tra le molecole d’acqua, dovuta ai legami a idrogeno che si formano tra l’atomo di ossigeno di una molecola e gli atomi di idrogeno di altre molecole vicine. Questa forte attrazione interna mantiene le molecole d’acqua unite, conferendo all’acqua una tensione superficiale elevata. L’adesione, invece, è la forza di attrazione tra le molecole d’acqua e le molecole di altre sostanze. Questa forza è particolarmente importante quando l’acqua interagisce con superfici polari o cariche. L’azione combinata di coesione e adesione è responsabile di molti fenomeni vitali.
Capillarità e Trasporto di Acqua nelle Piante
La capillarità è un fenomeno che illustra perfettamente l’interazione tra coesione e adesione. Si verifica quando l’acqua si muove all’interno di tubi sottili, come i vasi xilematici delle piante, contro la forza di gravità. La coesione mantiene le molecole d’acqua unite in una colonna continua, mentre l’adesione fa sì che l’acqua aderisca alle pareti dei vasi xilematici. Questa azione combinata permette all’acqua di “arrampicarsi” lungo i vasi, raggiungendo le foglie anche ad altezze considerevoli.
Immaginate un’immagine microscopica di un vaso xilematico: vedremmo una sottile colonna d’acqua che sale all’interno del vaso. Le molecole d’acqua, legate tra loro da forze di coesione, formano una sorta di catena. Ogni molecola d’acqua è anche attratta dalle pareti del vaso (adesione), contribuendo al movimento verso l’alto. La tensione superficiale dell’acqua, dovuta alla coesione, impedisce alla colonna d’acqua di rompersi, garantendo un flusso continuo. Questo processo è essenziale per il trasporto di acqua e nutrienti dalle radici alle foglie delle piante.
Processi Biologici Dipendenti da Coesione e Adesione
La coesione e l’adesione dell’acqua sono fondamentali per una varietà di processi biologici. Ecco tre esempi:
- Il trasporto di acqua e nutrienti nelle piante, come descritto sopra.
- La termoregolazione negli organismi viventi: l’elevata capacità termica specifica dell’acqua aiuta a mantenere una temperatura corporea stabile, mitigando le variazioni di temperatura ambientale.
- La lubrificazione delle articolazioni: la viscosità dell’acqua, dovuta alla coesione tra le sue molecole, facilita il movimento fluido delle articolazioni, riducendo l’attrito.
Calore Specifico e Termoregolazione

Source: numerade.com
L’acqua possiede una proprietà straordinaria che la rende fondamentale per la vita: un elevatissimo calore specifico. Questo significa che l’acqua assorbe e rilascia grandi quantità di calore senza subire variazioni di temperatura significative. Questa caratteristica gioca un ruolo cruciale nella termoregolazione, sia a livello cellulare che negli ecosistemi.
L’elevato calore specifico dell’acqua è dovuto ai forti legami a idrogeno tra le sue molecole. Per aumentare la temperatura dell’acqua, è necessario fornire molta energia per rompere questi legami, e viceversa, quando l’acqua si raffredda, viene rilasciata una grande quantità di energia sotto forma di calore. Questo meccanismo di “cuscinetto termico” è vitale per la sopravvivenza degli organismi viventi.
Confronto del Calore Specifico
Il calore specifico dell’acqua è significativamente più alto rispetto a quello di molte altre sostanze comuni. Questa differenza è fondamentale per capire il suo ruolo nella termoregolazione. Osserviamo la tabella seguente per un confronto:
| Sostanza | Calore Specifico (J/g°C) | Impatto sulla Termoregolazione |
|---|---|---|
| Acqua | 4.18 | Elevata capacità di assorbire e rilasciare calore, stabilizzando la temperatura. |
| Alcol etilico | 2.44 | Bassa capacità di assorbire calore, maggiore suscettibilità alle variazioni di temperatura. |
| Ferro | 0.45 | Molto bassa capacità di assorbire calore, variazioni di temperatura rapide. |
| Aria | 1.01 | Bassa capacità di assorbire calore, scarsa protezione dalle variazioni termiche. |
Mitigazione delle Fluttuazioni Termiche negli Ambienti Acquatici
L’elevato calore specifico dell’acqua ha un impatto profondo sulla stabilità termica degli ambienti acquatici. Grandi masse d’acqua, come oceani e laghi, agiscono come enormi serbatoi di calore, mitigando le fluttuazioni di temperatura giornaliere e stagionali. Questo crea un ambiente relativamente stabile, essenziale per la sopravvivenza di una vasta gamma di organismi acquatici.
Ad esempio, consideriamo un lago in una zona con estati calde e inverni freddi. Durante il giorno, l’acqua del lago assorbe grandi quantità di energia solare, riscaldandosi gradualmente. Grazie al suo elevato calore specifico, la temperatura dell’acqua aumenta più lentamente rispetto a quella dell’aria circostante, impedendo shock termici improvvisi alla vita acquatica. Analogamente, durante la notte e nei mesi invernali, l’acqua rilascia gradualmente il calore accumulato, impedendo che la temperatura scenda troppo rapidamente e proteggendo gli organismi acquatici dal congelamento. Questo effetto tampone è fondamentale per la sopravvivenza di pesci, piante acquatiche e altri organismi che non sono in grado di tollerare ampie variazioni di temperatura.
Densità dell’Acqua e Vita Acquatica
Source: cloudfront.net
L’acqua, come sappiamo, possiede proprietà uniche che la rendono essenziale per la vita. Tra queste, la sua densità gioca un ruolo fondamentale, soprattutto per gli organismi acquatici, influenzando la loro sopravvivenza, distribuzione e accesso alle risorse. In questo paragrafo approfondiremo come la densità dell’acqua, e in particolare il suo comportamento anomalo durante il congelamento, modella gli ecosistemi acquatici.
La densità dell’acqua è massima a 4°C. Questo significa che l’acqua a questa temperatura è più densa dell’acqua a temperature superiori o inferiori. La conseguenza più importante di questa caratteristica è che il ghiaccio, essendo meno denso dell’acqua liquida, galleggia. Questo fenomeno è cruciale per la sopravvivenza della vita acquatica, soprattutto in climi freddi.
Il Ghiaccio Galleggiante e la Sopravvivenza degli Organismi Acquatici
Se il ghiaccio fosse più denso dell’acqua, affonderebbe sul fondo dei laghi e degli oceani, creando uno strato di ghiaccio solido che impedirebbe il passaggio della luce e dell’ossigeno, causando la morte della maggior parte degli organismi acquatici. Invece, lo strato di ghiaccio superficiale funge da isolante, proteggendo l’acqua sottostante dal freddo estremo e permettendo la sopravvivenza di pesci, piante e altri organismi. Questo strato di ghiaccio, inoltre, crea un ambiente più stabile e meno soggetto a forti variazioni di temperatura. Ad esempio, in un lago ghiacciato, la temperatura dell’acqua sotto la superficie rimane relativamente costante attorno ai 4°C, garantendo un habitat adeguato per la fauna ittica.
Stratificazione Termica e Distribuzione degli Organismi
La densità dell’acqua, influenzata dalla temperatura, determina la stratificazione termica negli ambienti acquatici. Acque più fredde e dense tendono a occupare gli strati inferiori, mentre acque più calde e meno dense rimangono in superficie. Questa stratificazione crea diversi strati con caratteristiche chimico-fisiche differenti, influenzando la distribuzione degli organismi. Specie diverse presentano adattamenti specifici per vivere in questi diversi strati. Ad esempio, alcuni pesci sono adattati alle acque profonde e fredde, mentre altri preferiscono le acque superficiali più calde. La stratificazione termica può anche limitare il movimento verticale degli organismi, influenzando la loro ricerca di cibo e la riproduzione.
Densità dell’Acqua, Nutrienti e Ossigeno
La densità dell’acqua influenza il trasporto e la distribuzione di nutrienti e ossigeno negli ecosistemi acquatici. Le correnti convettive, generate dalle differenze di densità dovute a variazioni di temperatura e salinità, contribuiscono al rimescolamento delle acque, favorendo la distribuzione di ossigeno e nutrienti. Questi movimenti verticali di acqua, facilitati dalle differenze di densità, sono cruciali per mantenere la produttività degli ecosistemi acquatici. Ad esempio, il fenomeno dell’upwelling, in cui acque profonde e ricche di nutrienti risalgono in superficie, è un processo determinato dalle differenze di densità e ha un impatto significativo sulla produttività di molte zone costiere. Una diminuzione della stratificazione, ad esempio causata dall’inquinamento termico, può compromettere questi processi, con conseguenze negative per l’intero ecosistema.
Acqua come Reagente nelle Reazioni Biologiche
L’acqua, oltre ad essere un eccellente solvente e a possedere proprietà termiche uniche, svolge un ruolo fondamentale come reagente in numerose reazioni biochimiche essenziali per la vita. La sua polarità e la capacità di formare legami a idrogeno la rendono un partecipante attivo, non solo un semplice mezzo di reazione. Vediamo alcuni esempi chiave.
L’acqua partecipa attivamente a diverse reazioni, tra cui l’idrolisi e la disidratazione, processi cruciali per il metabolismo cellulare. Queste reazioni coinvolgono la rottura o la formazione di legami chimici, con l’acqua che fornisce o accetta atomi di idrogeno e ossigeno.
Idrolisi e Disidratazione
L’idrolisi è una reazione di decomposizione in cui una molecola d’acqua viene utilizzata per rompere un legame chimico, generalmente un legame covalente. Questo processo è essenziale per la digestione di molte macromolecole biologiche. Ad esempio, l’idrolisi dell’amido, un polisaccaride, produce molecole di glucosio. In questo caso, la molecola d’acqua si inserisce tra due unità di glucosio, rompendo il legame glicosidico e formando due nuove molecole con gruppi ossidrilici (-OH) provenienti dall’acqua. Analogamente, l’idrolisi dei lipidi, o grassi, porta alla formazione di acidi grassi e glicerolo. La reazione di idrolisi è catalizzata da enzimi specifici chiamati idrolasi.
La disidratazione, o reazione di condensazione, è il processo inverso dell’idrolisi. In questo caso, una molecola d’acqua viene rimossa quando due molecole più piccole si uniscono per formare una molecola più grande. Un esempio classico è la formazione di un legame peptidico tra due amminoacidi per formare una proteina. Durante questa reazione, un gruppo ossidrilico (-OH) da un amminoacido e un atomo di idrogeno (-H) dall’altro amminoacido si combinano per formare una molecola d’acqua, mentre i due amminoacidi si legano covalentemente. Anche la sintesi di polisaccaridi come il glicogeno avviene tramite reazioni di disidratazione.
Esempi di Reazioni Biologiche con Acqua come Reagente, How properties of water support life
È importante sottolineare il ruolo centrale dell’acqua in diverse reazioni metaboliche fondamentali. Ecco tre esempi:
- Idrolisi dell’ATP: L’adenosina trifosfato (ATP) è la principale fonte di energia nelle cellule. L’idrolisi dell’ATP in ADP (adenosina difosfato) e fosfato inorganico (Pi) rilascia energia utilizzabile per le attività cellulari. Questa reazione richiede una molecola d’acqua che rompe il legame fosfoanidridico ad alta energia.
- Fotosintesi: Durante la fotosintesi, l’acqua funge da donatore di elettroni, fornendo gli elettroni necessari per la riduzione del diossido di carbonio a glucosio. L’acqua viene ossidata, rilasciando ossigeno come sottoprodotto.
- Digestione delle proteine: Le proteine vengono digerite attraverso l’idrolisi dei legami peptidici che legano gli amminoacidi. L’acqua rompe questi legami, rilasciando singoli amminoacidi che possono essere assorbiti dall’organismo.
Conseguenze Biologiche di una Carenza Idrica nelle Reazioni Metaboliche
Una carenza di acqua ha conseguenze drammatiche sulle reazioni metaboliche. La mancanza di acqua impedisce o rallenta significativamente le reazioni che richiedono acqua come reagente.
- Riduzione dell’attività enzimatica: Molti enzimi richiedono un ambiente acquoso per funzionare correttamente. La disidratazione altera la struttura e la funzione degli enzimi, riducendo l’efficienza delle reazioni metaboliche.
- Compromissione della digestione: La digestione di carboidrati, proteine e lipidi dipende dall’idrolisi, che è impossibile senza acqua sufficiente.
- Disfunzione cellulare: La disidratazione causa alterazioni nella pressione osmotica all’interno e all’esterno delle cellule, portando a disfunzioni cellulari e potenzialmente alla morte cellulare.
- Aumento della produzione di radicali liberi: La disidratazione può aumentare la produzione di radicali liberi, dannosi per le cellule e associati all’invecchiamento e alle malattie.
- Difficoltà nella termoregolazione: La scarsità di acqua compromette la capacità del corpo di regolare la temperatura corporea attraverso la sudorazione.
In conclusione, l’acqua non è solo un elemento essenziale per la vita, ma un vero e proprio protagonista. Le sue proprietà fisiche e chimiche uniche, da semplici legami a idrogeno a fenomeni complessi come la capillarità, sono la chiave di volta per la sopravvivenza e la prosperità di ogni essere vivente. Comprendere a fondo queste proprietà ci permette di apprezzare ancora di più la complessità e la fragilità degli ecosistemi e l’importanza di preservare questa risorsa preziosa.

