Why can properties of a mixture vary – Perché variano le proprietà di una miscela? Questa domanda apre le porte a un mondo affascinante, dove la composizione di una sostanza influenza profondamente le sue caratteristiche. Immaginate l’acqua di mare: il suo sapore, la sua densità, persino il suo colore, cambiano a seconda della quantità di sale disciolto. Allo stesso modo, una lega metallica, come l’acciaio, possiede proprietà diverse a seconda delle proporzioni di ferro e carbonio. Esploreremo i fattori chiave che determinano queste variazioni, partendo dalle differenze tra miscele omogenee ed eterogenee e analizzando come temperatura, pressione e la presenza di altri componenti influenzano le proprietà fisiche e chimiche di una miscela.
Comprendere questo meccanismo è fondamentale in diversi campi, dalla chimica all’ingegneria dei materiali, permettendoci di progettare e manipolare le proprietà delle miscele per ottenere risultati specifici. Preparatevi a scoprire come la semplice variazione di concentrazione può portare a cambiamenti sorprendenti nelle proprietà di una miscela!
Introduzione: La natura delle miscele

Source: slideserve.com
Le miscele sono sistemi formati da due o più sostanze pure, chiamate componenti, che non sono legate chimicamente tra loro. Questo significa che le proprietà dei componenti si mantengono, anche se in una miscela le sostanze sono mescolate intimamente. La composizione di una miscela può variare, e questo è proprio ciò che determina la variabilità delle sue proprietà.
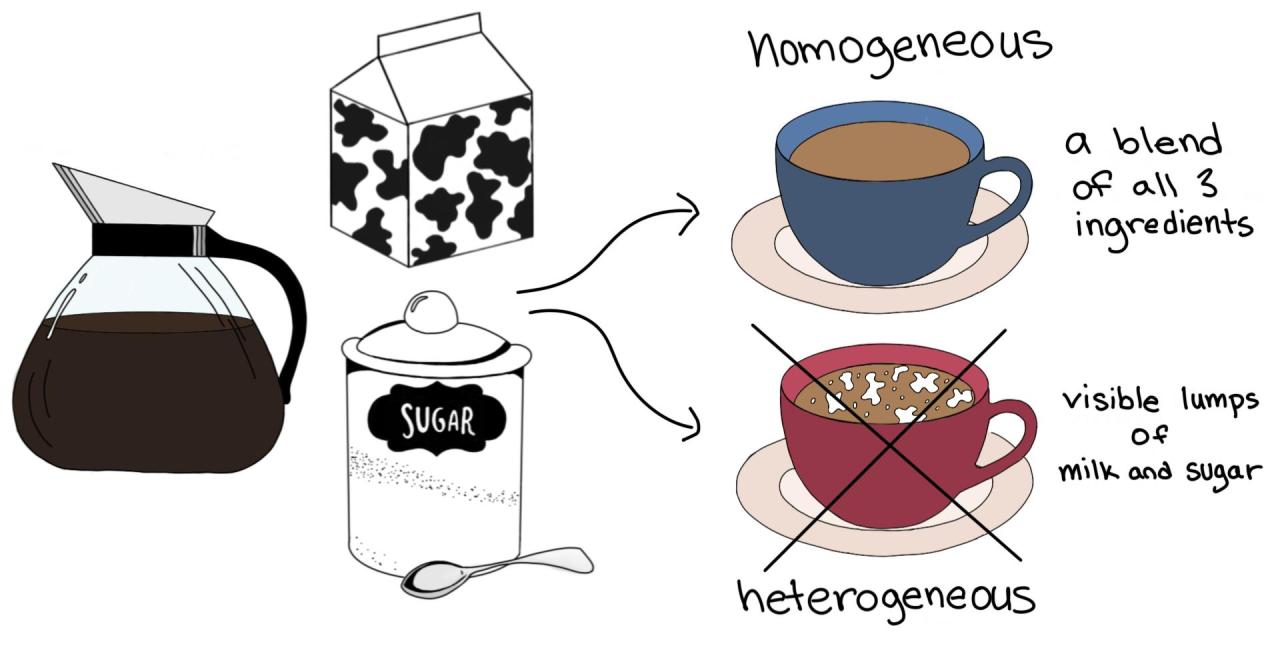
Una caratteristica fondamentale che distingue le miscele è l’uniformità della loro composizione. A seconda di questo aspetto, le miscele si classificano in omogenee ed eterogenee. Nelle miscele omogenee, i componenti sono distribuiti uniformemente, a livello microscopico, e non è possibile distinguere le diverse sostanze ad occhio nudo o con un semplice microscopio ottico. Nelle miscele eterogenee, invece, i componenti sono distribuiti in modo non uniforme, e si possono distinguere le diverse fasi (porzioni con composizione e proprietà diverse) ad occhio nudo o con un semplice ingrandimento.
Miscele omogenee ed eterogenee: un confronto
La tabella seguente riassume le principali differenze tra miscele omogenee ed eterogenee:
| Proprietà | Miscela Omogenea | Miscela Eterogenea | Esempio |
|---|---|---|---|
| Composizione | Uniforme a livello microscopico | Non uniforme | Aria (ossigeno, azoto, argon) / Granito (quarzo, feldspato, mica) |
| Aspetto | Appare uniforme ad occhio nudo | Appare non uniforme ad occhio nudo | Acqua salata / Sabbia e acqua |
| Separazione componenti | Difficile da separare i componenti con metodi fisici semplici | Facile separare i componenti con metodi fisici semplici (filtrazione, decantazione, ecc.) | Acqua e alcol / Acqua e olio |
| Proprietà | Proprietà uniformi in tutta la miscela | Proprietà variabili a seconda della zona considerata | Acqua zuccherata / Terra e sassi |
Fattori che influenzano la composizione delle miscele
Le miscele, a differenza delle sostanze pure, presentano una composizione variabile. Questa variabilità è dovuta a diversi fattori che possono influenzare la quantità e la distribuzione dei componenti all’interno della miscela stessa. Capire questi fattori è fondamentale per poter controllare e prevedere le proprietà di una miscela.
La composizione di una miscela può cambiare in risposta a modifiche nelle condizioni ambientali o attraverso l’aggiunta o la rimozione di componenti. Queste variazioni possono avere effetti significativi sulle proprietà fisiche e chimiche della miscela, come la densità, la viscosità, il punto di ebollizione e la solubilità.
Influenza della temperatura sulla solubilità
La temperatura gioca un ruolo cruciale nella solubilità di un soluto in un solvente. Generalmente, all’aumentare della temperatura, aumenta anche la solubilità di molti solidi nei liquidi. Questo fenomeno è spiegabile a livello molecolare considerando l’aumento dell’energia cinetica delle particelle. Con maggiore energia, le molecole del solvente riescono a rompere più efficacemente le forze intermolecolari che tengono insieme le particelle del soluto, permettendo una maggiore dissoluzione. Ad esempio, lo zucchero (saccarosio) si scioglie molto più facilmente in acqua calda che in acqua fredda. A livello molecolare, le molecole d’acqua ad alta temperatura possiedono maggiore energia cinetica e possono quindi interagire più efficacemente con le molecole di saccarosio, rompendo i legami intermolecolari tra le molecole di zucchero e permettendone una maggiore dispersione tra le molecole d’acqua. Al contrario, in alcuni casi, come per alcuni gas disciolti in liquidi, l’aumento di temperatura diminuisce la solubilità. Questo perché l’aumento di energia cinetica delle molecole di gas fa sì che esse superino più facilmente le forze attrattive del liquido e quindi sfuggano dalla soluzione. Un esempio comune è quello dell’anidride carbonica in una bibita: aprendo la bottiglia, la diminuzione della pressione fa sì che la CO2 disciolta esca dalla soluzione, ma anche un aumento di temperatura favorisce la fuoriuscita del gas.
Fattori che influenzano la composizione delle miscele: elenco di esempi
Di seguito un elenco di fattori che possono causare variazioni nella composizione di una miscela, con esempi specifici:
- Temperatura: Come visto precedentemente, la temperatura influenza la solubilità di un soluto in un solvente. Un aumento di temperatura può aumentare la solubilità dello zucchero in acqua, mentre può diminuire la solubilità di un gas in un liquido.
- Pressione: La pressione influenza principalmente la solubilità dei gas nei liquidi. Aumentando la pressione, aumenta la solubilità del gas. Un esempio classico è quello delle bevande gassate, dove l’alta pressione durante l’imbottigliamento mantiene disciolta una grande quantità di anidride carbonica.
- Aggiunta di componenti: L’aggiunta di un nuovo componente a una miscela ne modifica inevitabilmente la composizione. Ad esempio, aggiungendo sale a una soluzione di acqua e zucchero, si modifica la concentrazione di entrambi i soluti.
- Rimozione di componenti: Analogamente all’aggiunta, la rimozione di un componente altera la composizione della miscela. L’evaporazione dell’acqua da una soluzione salina ne aumenta la concentrazione di sale.
- Reazioni chimiche: Se all’interno di una miscela avvengono reazioni chimiche, la composizione della miscela cambierà a seguito della formazione di nuovi prodotti. Ad esempio, la miscela di acido cloridrico e idrossido di sodio porta alla formazione di sale e acqua, modificando completamente la composizione iniziale.
Variazione delle proprietà fisiche: Why Can Properties Of A Mixture Vary

Source: slideplayer.com
Le proprietà fisiche di una miscela, come punto di ebollizione, punto di fusione, densità e colore, dipendono direttamente dalla composizione della miscela stessa. Modificando le proporzioni dei componenti, si osservano variazioni significative in queste proprietà. Questo perché le proprietà delle singole sostanze si combinano in modo non sempre lineare all’interno della miscela.
La variazione della composizione di una miscela influenza in modo significativo le sue proprietà fisiche. Consideriamo, ad esempio, una soluzione di sale (NaCl) in acqua (H₂O). All’aumentare della concentrazione di sale, il punto di ebollizione della soluzione aumenta, mentre il punto di congelamento diminuisce. Allo stesso modo, la densità della soluzione aumenta con l’aumentare della concentrazione di sale, e il colore potrebbe cambiare leggermente, sebbene in questo caso il cambiamento sia meno evidente. Anche il colore può essere influenzato: una miscela di pigmenti, per esempio, avrà un colore che dipende dalle proporzioni di ciascun pigmento.
Influenza della concentrazione sulla densità
Consideriamo due miscele di acqua e alcol etilico. La miscela A contiene il 20% di alcol etilico e l’80% di acqua, mentre la miscela B contiene il 50% di alcol etilico e il 50% di acqua. La densità dell’alcol etilico è inferiore a quella dell’acqua. Di conseguenza, la miscela B, con una maggiore percentuale di alcol etilico, avrà una densità minore rispetto alla miscela A. Questo perché la presenza di una maggiore quantità di alcol etilico, meno denso dell’acqua, “diluisce” la densità complessiva della miscela.
Rappresentazione grafica della relazione concentrazione-densità
Possiamo rappresentare graficamente la relazione tra la concentrazione di un componente (ad esempio, l’alcol etilico) e la densità della miscela. Il grafico sarebbe un diagramma cartesiano. L’asse delle x rappresenterebbe la concentrazione percentuale di alcol etilico (da 0% a 100%), mentre l’asse delle y rappresenterebbe la densità della miscela (in g/ml, ad esempio). La curva risultante non sarebbe una linea retta, ma piuttosto una curva leggermente inclinata verso il basso. Partendo da una densità di circa 1 g/ml (densità dell’acqua pura al 0% di alcol), la densità diminuirebbe gradualmente all’aumentare della concentrazione di alcol etilico, raggiungendo la densità dell’alcol etilico puro (circa 0.79 g/ml) al 100%. La curva rifletterebbe la non-linearità della relazione tra concentrazione e densità, a causa delle interazioni tra le molecole di acqua e alcol etilico. Punti sperimentali potrebbero essere plottati sul grafico per mostrare i valori di densità misurati a diverse concentrazioni. Una linea di tendenza potrebbe essere tracciata per visualizzare meglio la relazione.
Variazione delle proprietà chimiche
Source: cloudfront.net
La composizione di una miscela influenza profondamente le sue proprietà chimiche, andando a determinare la sua reattività e il tipo di reazioni che può subire. A differenza delle proprietà fisiche, che spesso si possono prevedere semplicemente dalla somma delle proprietà dei componenti, le proprietà chimiche di una miscela possono essere molto più complesse e imprevedibili. La presenza di alcuni componenti può catalizzare o inibire reazioni, alterando significativamente il risultato finale.
La reattività chimica di una miscela dipende dalla concentrazione dei suoi componenti e dalle interazioni tra di essi. Un aumento o una diminuzione della concentrazione di un reagente, ad esempio, può influenzare direttamente la velocità di una reazione, mentre la presenza di altri componenti può agire da catalizzatore, accelerando la reazione, o da inibitore, rallentandola. Anche la formazione di nuovi composti all’interno della miscela, a seguito di reazioni tra i suoi componenti, può modificare radicalmente le sue proprietà chimiche.
Influenza della composizione sulla velocità di reazione
Un esempio classico è la reazione tra un acido e un metallo. Se aggiungiamo un pezzo di zinco (Zn) ad una soluzione di acido cloridrico (HCl), si verifica una reazione che produce idrogeno gassoso (H₂) e cloruro di zinco (ZnCl₂). La velocità di questa reazione dipende dalla concentrazione dell’acido. Una soluzione di HCl più concentrata reagirà più velocemente con lo zinco, producendo una maggiore quantità di idrogeno in un tempo minore rispetto ad una soluzione più diluita. Allo stesso modo, la presenza di altri ioni nella soluzione può influenzare la velocità della reazione, ad esempio alcuni ioni possono complessare lo zinco, rallentando la reazione.
Influenza della composizione sul prodotto finale, Why can properties of a mixture vary
Consideriamo la combustione di una miscela di idrocarburi. La composizione di questa miscela, ovvero la proporzione di diversi idrocarburi presenti, influisce direttamente sui prodotti della combustione. Una miscela ricca di idrocarburi a catena corta tenderà a produrre una fiamma più calda e una maggiore quantità di anidride carbonica (CO₂) e acqua (H₂O). Al contrario, una miscela ricca di idrocarburi a catena lunga può produrre una fiamma più fumosa, con una maggiore quantità di fuliggine (carbonio) e monossido di carbonio (CO), un gas tossico. In questo caso, la variazione della composizione della miscela determina una variazione significativa nella natura dei prodotti della reazione, con conseguenze importanti in termini di sicurezza e impatto ambientale.
Esempi concreti di variazioni nelle proprietà delle miscele
Le proprietà di una miscela, come abbiamo visto, dipendono fortemente dalla composizione e dalle proporzioni dei suoi componenti. Osserviamo ora alcuni esempi concreti che illustrano questa variabilità, prendendo in considerazione sia sistemi naturali che artificiali. Questi esempi ci aiuteranno a comprendere meglio l’importanza del controllo della composizione nelle miscele, sia in contesti naturali che industriali.
Acqua di mare: un esempio di miscela naturale variabile
La composizione dell’acqua di mare varia significativamente a seconda della posizione geografica e delle condizioni ambientali. Vicino alle foci dei fiumi, la salinità è minore a causa dell’apporto di acqua dolce. In regioni aride, con elevata evaporazione, la salinità aumenta, così come in aree con scarsa precipitazione. Anche la temperatura influisce sulle proprietà dell’acqua di mare, modificandone la densità e la capacità di sciogliere i gas. La presenza di organismi viventi, inoltre, contribuisce a variare la composizione chimica dell’acqua, con concentrazioni diverse di nutrienti e di altre sostanze organiche. Un esempio concreto è il Mar Morto, con la sua elevata salinità che ne determina una densità tale da permettere a una persona di galleggiare facilmente. Al contrario, l’acqua dell’Oceano Atlantico presenta una salinità minore e una composizione chimica differente.
Leghe metalliche: un esempio di miscela industriale a composizione controllata
Nell’industria metallurgica, la produzione di leghe metalliche rappresenta un esempio eccellente di come il controllo preciso della composizione di una miscela sia fondamentale per ottenere le proprietà desiderate nel prodotto finale. Le leghe sono miscele di due o più metalli (o di metalli e non metalli), e le loro proprietà, come resistenza, duttilità, punto di fusione e resistenza alla corrosione, dipendono in modo critico dalle proporzioni dei componenti. Ad esempio, l’acciaio inossidabile è una lega di ferro, cromo e nichel; la percentuale di cromo è cruciale per la resistenza alla corrosione. Variando le percentuali di questi elementi, si ottengono acciai inossidabili con caratteristiche diverse, adatti a impieghi specifici. Un’altra lega molto utilizzata è l’ottone, una lega di rame e zinco, le cui proprietà variano in base alla percentuale di zinco presente. Un ottone con alta percentuale di zinco sarà più duttile, mentre uno con minore percentuale di zinco sarà più resistente.
Esperimento sulla variazione delle proprietà di una soluzione salina
Questo esperimento dimostra come la variazione della concentrazione di un soluto in una soluzione (miscela omogenea) modifichi le proprietà della miscela stessa, in questo caso la densità.
Procedura:
1. Preparare tre soluzioni di cloruro di sodio (sale da cucina) in acqua, con concentrazioni diverse: una soluzione satura (con la massima quantità di sale disciolto), una soluzione concentrata (con una quantità significativa di sale disciolto) e una soluzione diluita (con una piccola quantità di sale disciolto).
2. Riempire tre cilindri graduati con le tre soluzioni preparate, annotando attentamente il volume di ciascuna soluzione.
3. Misurare la massa di ciascun cilindro graduato contenente la soluzione, utilizzando una bilancia di precisione.
4. Calcolare la densità di ciascuna soluzione utilizzando la formula: Densità = Massa/Volume.
5. Confrontare le densità ottenute. Si osserverà che la densità aumenta all’aumentare della concentrazione del sale. La soluzione satura avrà la densità maggiore, mentre la soluzione diluita avrà la densità minore. Questo esperimento dimostra chiaramente come la variazione della composizione di una miscela (in questo caso, la concentrazione del soluto) influenzi le sue proprietà fisiche (in questo caso, la densità).
In conclusione, le proprietà di una miscela sono strettamente legate alla sua composizione. Abbiamo visto come fattori come temperatura, pressione e la proporzione dei componenti influenzino sia le proprietà fisiche (punto di ebollizione, densità, colore) che quelle chimiche (reattività). Da semplici esperimenti in laboratorio a processi industriali complessi, la comprensione di questa relazione è fondamentale per il controllo e la manipolazione delle caratteristiche delle miscele, aprendo la strada a innovazioni in numerosi campi scientifici e tecnologici. Sperimentate, osservate e lasciatevi sorprendere dalla versatilità delle miscele!
